REACCIONES DE OXIDOREDUCCION REACCIONES QUÍMICAS SALES SOLUCIONES TEORÍA CINETICA TEORÍA DE ARRHENIUS ÁCIDOS Y BASES ÓXIDOS Y HIDROXIDOS Mapa del sitio ESTRUCTURA DE LEWIS ESTRUCTURAS DE LEWIS Las estructuras, diagramas o fórmulas de Lewis (USA, 1916)RESUMEN El ácido hipocloroso (HOCl) es un potente antimicrobiano no antibiótico utilizado en medicina clínica para el control de infecciones y reparación de heridasIn vivo el HOCl es sintetizado por células del sistema inmune para el control del agente patógeno durante la fagocitosis y ha sido sintetizado y estabilizado en el laboratorio con potenciales aplicaciones profilácticas y3 Ejemplo 2 Para la siguiente estructura de Lewis de monóxido de carbono, CO Carga formal en el oxígeno = 6 (carga del core) 5 (electrones asignados) = 1 Carga formal en el carbono = 4 (carga del core) 5 (electrones asignados) = 1 La carga formal se encierra en un círculo y se escribe al lado del símbolo del átomo

Calameo Practicas Dirigidas De Quimica 4to Sec
Estructura de lewis del oxido hipocloroso
Estructura de lewis del oxido hipocloroso-Se trata de un compuesto muy soluble en agua así como en CCl 4 El óxido de cloro (I) es un anhídrido formado por 2 átomos de cloro 1 átomo de oxígeno Propiedades Las principales propiedades del óxido de cloro (I) (Cl2O) son Masa molar 86,90 g/mol Punto de fusión 1,6 °C Punto de ebullición °C Obtención del óxido de cloro (I)0709 · El ácido hipocloroso es inestable en su forma pura, por lo que existe en una solución con agua Es un ácido débil, clasificado como oxoácido, porque contiene oxígeno en su fórmula química La estructura de Lewis del ácido hipocloroso tiene oxígeno (O) con enlaces simples entre el hidrógeno y el cloro



Acido Clorico Wikipedia La Enciclopedia Libre
· Oxido hipocloroso 3 Hidruros Se producen al combinar metales con hidrogeno Formula Stock Sistematica Tradicional CuH2 Hidruro de cobre Estructura de Lewis y Regla del Octeto Enlace Quimico (Ionico, Covalente, Metalico) Estructura de Lewis y Regla del Octeto Aug 1st 1 Problemas y ejercicios de Estequiometria ProblemasC) Escribe la estructura de Lewis del compuesto formado 12 ¿Cuáles de las siguientes sustancias pueden considerarse iónicas y cuáles covalentes?En total, hay tres estructuras de puntos de Lewis válidas para el óxido nitroso La primera estructura de puntos de Lewis contiene nitrógeno como el átomo central con un doble enlace al oxígeno y un doble enlace al nitrógeno a su derecha El oxígeno y el nitrógeno con doble enlace tienen cuatro electrones individuales
La estructura de Lewis, también llamada diagrama de punto y raya diagonal, modelo de Lewis, representación de Lewis o fórmula de Lewis, es una representación gráfica que muestra los pares de electrones de enlaces entre los átomos de una molécula y las partes de las moléculas que puedan existir Son representaciones adecuadas y sencillas de iones y compuestos, que facilitan · La estructura de Lewis del Ácido Hipocloroso (HClO) es HOCl Espero te sirva, suerte 3Dibuje la Estructura de Lewis del óxido de dicloro (Cl 2O) Dibuje la Estructura de Lewis del nPropanol (CH 3CH2CH2OH) Dibuje la Estructura de Lewis del Dinitrógeno (N2) Dibuje la estructura de Lewis del Ácido perclórico (HClO4) Dibuje la Estructura de Lewis del Ácido Cinhídrico (HCN) Dibuje la Estructura de Lewis del Ión Amonio
· El ácido hipocloroso es un líquido incoloro que presenta un ligero olor a cloro con propiedades físicas variables que dependen de su concentración Tiene un peso molecular de 86,90 g/mol, siendo muy establece al contacto de materia orgánica, no es tóxico, irritante o corrosivoLa estructura de Lewis, también llamada diagrama de punto, modelo de Lewis o representación de Lewis, es una representación gráfica que muestra los pares de electrones de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existirA) Fluoruro de estroncio, SrF 2 b) Fosfina, PH 3 c) Óxido de potasio, K 2O d) Óxido hipocloroso, Cl2O e) Nitrógeno, N 2 f) Cloruro de Berilio, BeCl2 g) Bromuro de hidrógeno, HBr



Estructuras De Lewis Quimica Inorganica
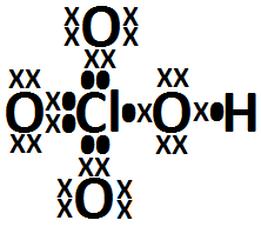


Enlaces Quimicos Y Estructuras De Lewis Resultados A Ejercicios
Óxido de césio (nome IUPAC) descreve compostos inorgânicos compostos de césio e oxigênioOs seguintes óxidos de césio binários (contendo somente Cs e O) são conhecidos Cs 11 O 3, Cs 4 O, Cs 7 O e Cs 2 O 3 Cs 2 O é higroscópico, formando o hidróxido corrosivo CsOH em contato com água Referências14 Estructura de Lewis de NO 2, óxido de nitrógeno(IV) o dióxido de nitrógeno ⇐ Al índice 1Cuenta el número total de electrones (N T) de la capa de valencia para los átomos de la moléculaAl realizar la Estructura de Lewis, se presenta el esquema de la siguiente manera Cl O Cl De tal forma que el O sea el átomo central y comparta 1 electrón a cada Cl La Nomenclatura del compuesto, en el caso de los óxidos no metálicos es Óxido (porque contiene O) de (No Metal) (Estado de Oxidación del No Metal) o Óxido (Metal hipooso/oso/ico/perico dependiendo del Estado de



Hclo Definicion Y Estructura De Lewis Estudyando



Estructura Lewis
El cloruro de sodio, está formado por los iones de carga opuesta Cl– y Na, y la formula de Lewis correspondiente es También son sustancias iónicas las formadas por un catión metálico y un radical negativo como los iones SO 4 3 , PO4 3, etc Para escribir el modelo de Lewis de un anion o radical, se suprimen de la formula del acido los H de los grupos OH, y se colocan tantas cargasLas moléculas con enlaces Covalentes Polares por lo general son asímetricas, tienen momento dipolar distinto de 0, son solubles en solventes polares (como agua o alcohol), entre otras características 7 Estructura de Lewis del óxido hipocloroso (o monóxido de dicloro)Oxido de carbono El óxido de carbono (IV), también denominado dióxido de carbono, gas carbónico y anhídrido carbónico, es un gas cuyas moléculas están compuestas por dos átomos de oxígeno y uno de carbono Su fórmulaquímica es CO2 Su representación por estructura de Lewis



Acido Clorico Wikipedia La Enciclopedia Libre
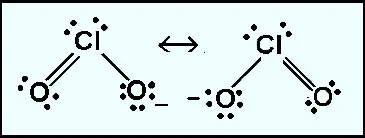


Estructura De Lewis Del Clo2 Dioxido De Cloro
La estructura de Lewis del óxido de dicloro incluye dos enlaces covalentes, uno para cada cloro con el átomo central, el oxígeno La regla del octeto se cumple al repartir los ocho pares de electrones no compartidos de la siguiente forma 3 pares para cada átomo de cloro y dos pares para el átomo centralEstructura de Lewis para la molécula Para que el átomo de oxígeno que no está unido con un hidrógeno pueda completar su octeto, necesita dos electrones que son donados por el átomo central, el arsénico, por lo tanto es covalente dativo, luego tanto el arsénico como el oxígeno citado presentarán carga iónica, aunque la carga neta de la molécula sea ceroWolframAlpha Widgets "Generador de Estructuras de Lewis ITPA" Free Chemistry Widget



Calameo Practicas Dirigidas De Quimica 4to Sec



Anhidrido Hipocloroso Ecuacion Quimica
FORMULACIÓN La suma de los números de oxidación de los átomos que constituyen un compuesto, multiplicados por sus respectivos subíndices, es cero La valencia de un átomo es el nº de electrones perdidos (electrovalencia ), ganados (electrovalencia ) o compartidos (covalencia) por dicho átomo al combinarse con otro Número de oxidación de un átomo "X" en un compuesto es un número que nos da la carga que presenta dicho átomo si los electrones de78 Formular los siguientes compuestos químicos 1 Fosfuro de aluminio 2 Disulfuro de carbono 3 Óxido hipocloroso 4 Yoduro de hidrógeno 5 Tetrabromuro de platino 6 Metano 7 Hidruro de bario 8 Ácido bromhídrico 9 Óxido de azufre IV 10 Dihidruro de hierro 11 Óxido de platino IV 12 Sulfuro de calcio 13 Óxido de magnesioNomenclatura Estructura de Lewis Formula a) agua H y O H 2 O b) Oxido de litio Li y O c) Cloro Cl y Cl d) Sulfuro de hidrogeno H y S e) Yoduro de sodio Na y I f) Cloruro de litio Li y Cl g) Nitrógeno N y N Liceo de Educación de Adultos "Juan



Grafique La Estructura De Lewis Del Oxido De Dicloro Cl2o Ayuda Porfa Brainly Lat



Estructura Lewis
About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy & Safety How works Test new features Press Copyright Contact us CreatorsEstructura de Lewis del CO2 (Dióxido de Carbono) Estructura de Lewis del SO3 (Trióxido de Azufre) Estructura de Lewis del HNO3 (Ácido Nitrico) Estructura de Lewis del O2 ( Oxígeno ) Estructura de Lewis del H2O (Agua) · La estructura Lewis es lineal, para hacer el dibujo lo graficaremos de este modo y el átomo de oxigeno lo situaremos en el centro Cl O Cl Ver más brainlylat/tarea/



Clorato Hipoclorito Atomo Ion Ester Diverso Esfera Quimica Png Klipartz



El Acido Hipocloroso Acido Clorico Acido Imagen Png Imagen Transparente Descarga Gratuita
· ESTRATEGIA PARA LA ESCRITURA DE ESTRUCTURAS DE LEWISPrimeramente se debe establecer el número de electrones de valencia en la fórmula Esto requerirá que usted conozca la tabla Periódica El número de la familia a la que pertenece el átomo corresponde al número de electrones de Valencia Ej 1 CH4 carbono familia 4A 4 electrones deEstructura de Lewis del CO2 (Dióxido de Carbono) Estructura de Lewis del SO3 (Trióxido de Azufre) Estructura de Lewis del HNO3 (Ácido Nitrico) Estructura de Lewis del O2 ( Oxígeno ) Estructura de Lewis del H2O (Agua)En este ejercicio determinaremos las estructuras de Lewis de los oxoácidos del cloro, es decir, ácido hipocloroso , cloroso, clórico y perclórico HIPOCLOROSO EN LOS PROCESOS DE DESINFECCIÓN L de una disolución de hidróxido de sodio 1M, razona Su utilidad deriva de su capacidad oxidante y de liberar ácido hipocloroso



Oxidos Introduccion Tipos De Oxidos Estructura Caracteristicas Y Propiedades Fisico Quimicas Y Aplicaciones Revisen Que Es Lo Que Debe Aparecer En Ppt Descargar
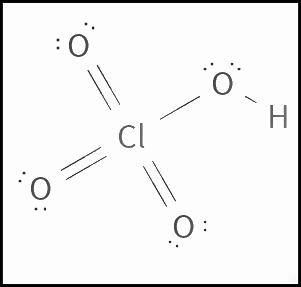


Anhidrido Cloroso Formula Molecular
Acido bromhidrico estructura de lewis Para escribir la fórmula electrónpunto del ácido nítrico, HNO3, se pueden seguir los siguientes pasos Paso 1 Calcule el número total de electrones externos 1 átomo de N = 5 e 3 átomos de O = 18 e 1 átomo de H = 1 e HNO3 = 24 e externos Cada uno de los átomos de oxígeno tiene 6 electrones exteriores, 10619 · 👍 La respuesta correcta es a la pregunta Grafique la estructura de lewis del óxido de dicloro (cl2 o) eeducacioncomSu estructura de Lewis es la que se muestra en la fórmula 1 Se pueden escribir estructuras de resonancia (fórmula 2) El átomo de N contiene un electrón desapareado, por tanto, el NO presenta propiedades paramagnéticas, radicalarias El orden de enlace es de 2,5



Acido Cloroso Hclo2 Formula Propiedades Y Usos



Estructuras De Lewis Quimica Inorganica
Introduccin La estructura de Lewis, es una representacin grfica que muestra los pares de electrones de enlaces entre los tomos de una molcula y los pares de electrones solitarios que puedan existir Son representaciones adecuadas y sencillas de iones y compuestos, que facilitan el recuento exacto de electrones y constituyen una base importantes estabilidades relativasReacciÓn de formaciÓn nomenclatura tradicional stock iupac estructura de lewis fo'rmula desarrollada resonancia tipo de molÉcula geometrÍa molecular 2cl2(g) o2(g) à 2 cl2o(g) Óxido hipocloroso cl o cl cl o cl m polar gm angular 2cl2(g) 3o2(g) à 2 cl2o3(g) Óxido cloroso o cl o cl o o cl o cl o cl2(g) 4o2(g) à 2clo2(g) diÓxido de cloroóxido de potasio yoduro de potasio estructura lewis, símbolo de punto lewis, ángulo, texto, logo png Diagrama de sulfuro de calcio de estructura lewis, relleno de punto, texto, logo, electrón png Logotipo de youtube, patrón de papel en blanco y negro, botón de reproducción de youtube, ángulo, blanco, texto png



Ejercicios Modelos De Lewis Moleculas Enlace Quimico



Hclo Definicion Y Estructura De Lewis Estudyando
La estructura de fosfato de Lewis debe distribuir tres enlaces covalentes, uno para cada hidrógeno La regla del octeto se hace porque todavía hay un par de electrones inseparables que completan 8 electrones la estructura de Lewis de óxido de dicloro incluye dos enlaces covalentes, uno para cada cloro con un átomo central, el oxígeno



Oxido Hipocloroso Formula Molecular Oxido Perclorico


Exe



Estructura De Lewis Del Acido Hipocloroso Brainly Lat



Calameo 10 2 3 Hipocloritodesodio



Actividad De Enlaces Quimicos


Formulacion Estructural Inorganica



Estructura Lewis



Acido Hipocloroso Wikipedia La Enciclopedia Libre



Hclo Definicion Y Estructura De Lewis Estudyando



Estructura Lewis
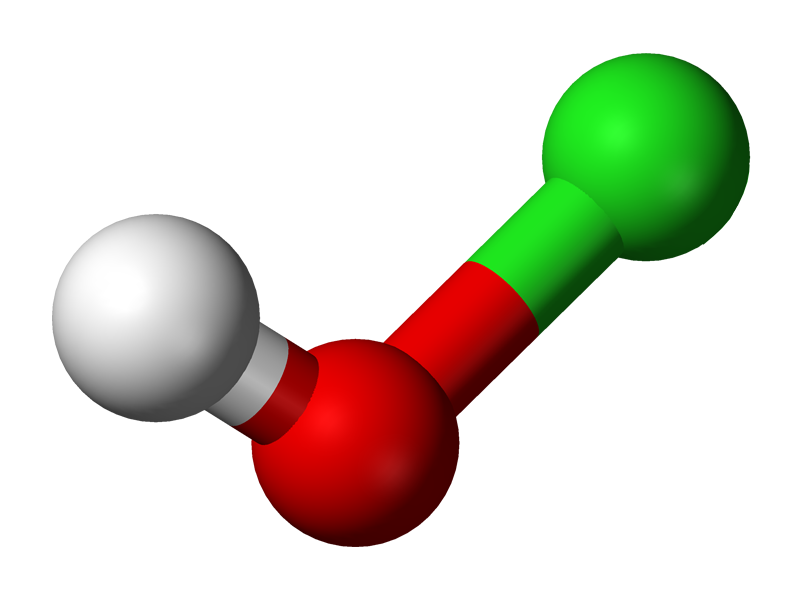


Acido Hipocloroso Hclo Estructura Propiedades Usos Sintesis



Estructura De Lewis Hclo4 Enlace Covalente Normal Polar Y Dativo Youtube



Oxido Hipocloroso Formula Molecular Oxido Perclorico



Estrcutura De Lewis Para El Anhidrido Clorico Brainly Lat



Enlace Quimico Actos 6 Estructuras De Lewis De Los Oxoacidos Del Cloro Oxido Hipocloroso Formula Molecular



La Estructura De Lewis Descarga Gratuita De Png La Estructura De Lewis De Dioxido De Carbono De Resonancia Diagrama De Electrones La Estructura De Lewis Imagen Png Imagen Transparente Descarga Gratuita
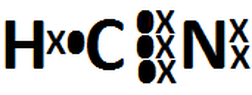


Enlaces Quimicos Y Estructuras De Lewis Resultados A Ejercicios
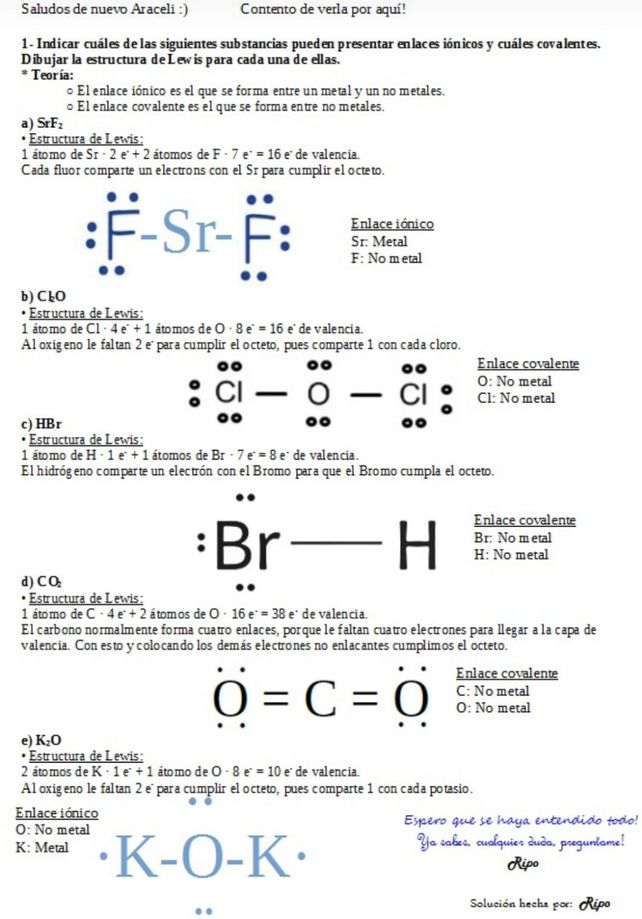


1 Indicar Cuales De Las Descubre Como Resolverlo En Qanda



Acido Hipocloroso Cloroso Clorico Perclorico Youtube



El Acido Hipocloroso Acido Clorico Acido Imagen Png Imagen Transparente Descarga Gratuita
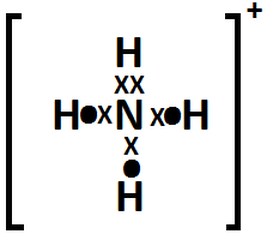


Enlaces Quimicos Y Estructuras De Lewis Resultados A Ejercicios



Pin En Quimica



Estructura De Lewis Hclo Acido Hipocloroso Youtube



2



Estructura De Lewis Del Oxido De Dicloro Cl2o Brainly Lat
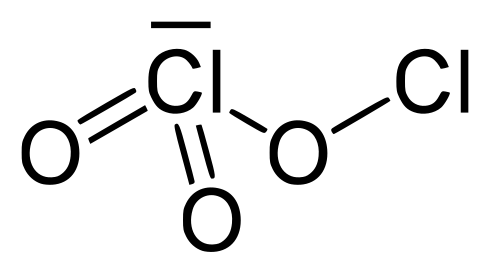


Oxido De Cloro Iii Wikiwand



Estructuras De Lewis Quimica Inorganica


Formulacion Inorganica Oxido De Selenio 6 Anhidrido Bromico Video Dailymotion



Doc Formula Empirica Jorge Correa Academia Edu



Oxido De Cloro Iii Wikipedia La Enciclopedia Libre



Las Tres Estructuras De Lewis Del Oxido Nitroso N2o Y Quien Invento En Detector De Captura Electronica Ecd Compostando Ciencia
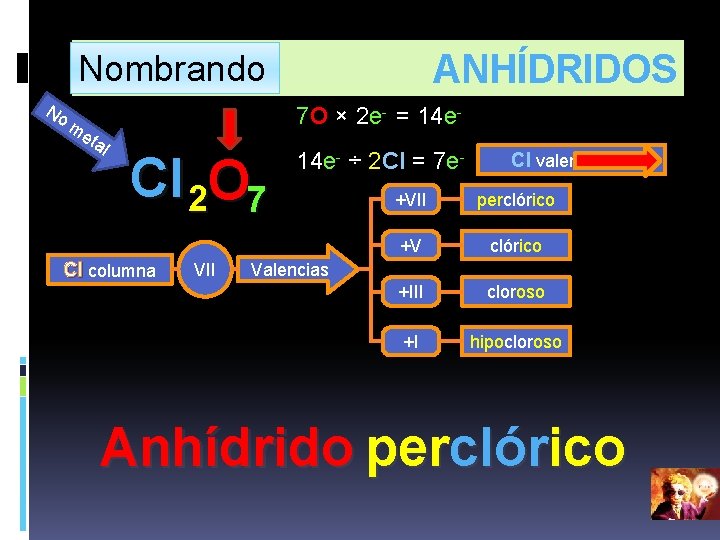


Anhidrido Hipocloroso Ecuacion Quimica



Cual Es La Formula Del Anhidrido Hipocloroso Compuestos Quimicos Sustancias Quimicas



Enlaces Quimicos Y Estructuras De Lewis Resultados A Ejercicios



Estructura Lewis
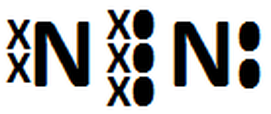


Enlaces Quimicos Y Estructuras De Lewis Resultados A Ejercicios



Acido Hipocloroso Hclo Estructura Propiedades Usos Sintesis



Acido Hipocloroso Hclo Estructura Propiedades Usos Sintesis



La Estructura De Lewis Descarga Gratuita De Png La Estructura De Lewis De Dioxido De Carbono De Resonancia Diagrama De Electrones La Estructura De Lewis Imagen Png Imagen Transparente Descarga Gratuita



Oxido Hipocloroso Formula Molecular Oxido Perclorico
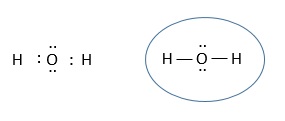


Estructura Molecular Teorias Del Enlace Covalente Teoria De Lewis Teoria De Lewis En 1916 Gilbert Newton Lewis Propuso Que El Enlace Covalente Entre Atomos Se Produce Por Comparticion De Pares De Electrones Mecanismo Por


Exe



Doc Estructura De Lewis Beto Gonzalez Academia Edu



Anhidrido Hipocloroso Ecuacion Quimica
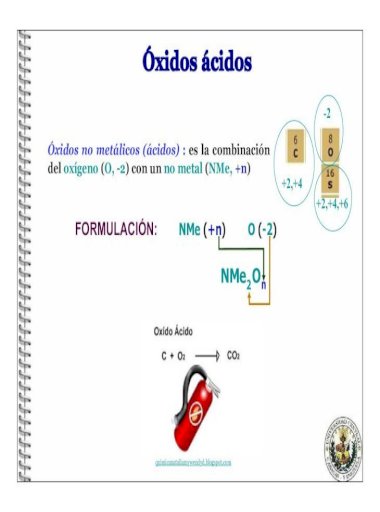


Anhidrido Hipocloroso



Estructura De Lewis Cl2o Enlace Covalente Normal Polar Youtube



Trabajo Practico Oxido Acido



Estructura Lewis



Oxido Ferrico Formula Molecular



Anhidrido Hipocloroso Ecuacion Quimica


Pagina Nueva 1
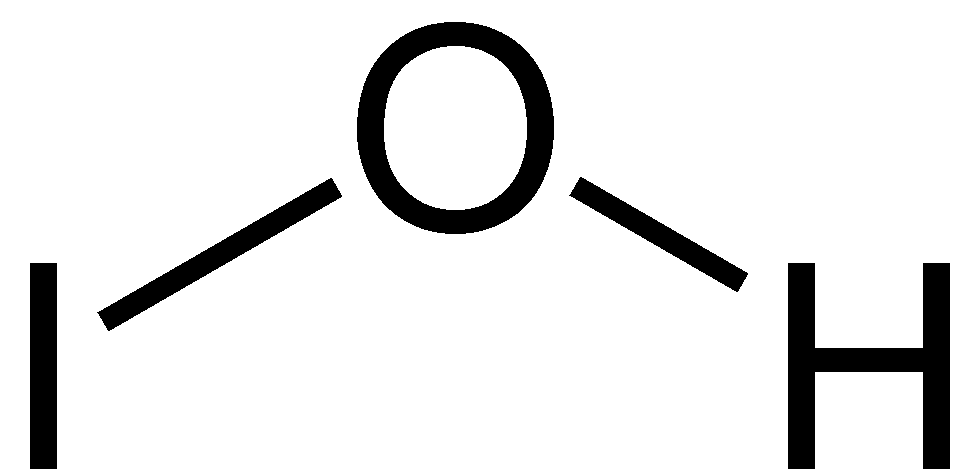


Acido Hipoyodoso Wikipedia La Enciclopedia Libre



Quimica Noviembre 13



Estructuras De Lewis Quimica Inorganica


Estructura Lewis



Estructura De Lewis Del Acido Hipocloroso Youtube


Formula Electron Punto O De Lewis 04 1ª Parte El Sapo Sabio



Black Circle



Acido Hipocloroso Wikipedia La Enciclopedia Libre



La Estructura De Lewis Electronica El Cloro Imagen Png Imagen Transparente Descarga Gratuita



Quimica 14
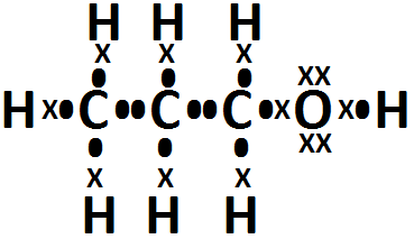


Enlaces Quimicos Y Estructuras De Lewis Resultados A Ejercicios



Ejercicios Modelos De Lewis Moleculas Enlace Quimico



Problema Acido Hipocloroso Youtube



Estructuras De Lewis De Los Oxoacidos Del Cloro Quimitube



Estructura De Lewis Del Trioxido De Azufre So3 Youtube



Hclo Definicion Y Estructura De Lewis Estudyando



Anhidrido Hipocloroso Ecuacion Quimica



Serie 1 Teoria De Lewis Hidrogeno Carbon



Oxido Hipocloroso Formula Molecular Oxido Perclorico



Estructura De Lewis Del Oxido De Dicloro Cl2o Brainly Lat



1 Cual Es La Estructura De Lewis Correcta De Acido Hipocloroso Un Compuesto Que Contiene Cloro Hidrogeno Y Oxigeno Pdf Descargar Libre
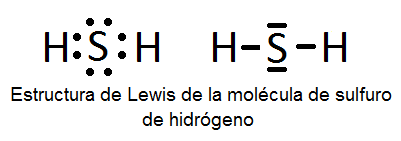


Estructuras De Lewis De Algunas Moleculas Covalentes Sencillas Sin Resonancia Quimitube



Hclo Definicion Y Estructura De Lewis Estudyando



Acido Perclorico Formula Di Lewis



Cloro Acido Descarga Gratuita De Png El Acido Hipocloroso Acido Clorico La Geometria Molecular El Acido Hipocloroso Imagen Png Imagen Transparente Descarga Gratuita


Pagina Nueva 1



0 件のコメント:
コメントを投稿